国内外罕见病文献及政策汇总丨2020年9月-10月
罕见病联盟
2020年9-10月份国内外罕见病文献及政策汇总。
2020年9-10月份罕见病政策汇总
一、医保政策
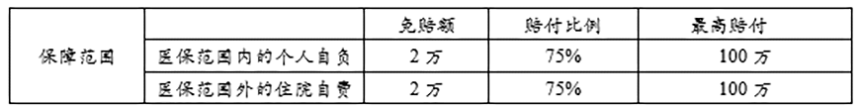
1. 2020年9月8日,合肥首款普惠型商业补充医疗保险“合惠保”正式发布
(1)合惠保除了恶性肿瘤、肝肾疾病等5类重大既往症及其并发病而造成的医疗费用不予赔付,其他病症产生的医疗费用均可按照保险责任进行赔付。
(2)报销不限医保目录范围,自费药也能报销,与现行医疗保障体系互补充。
2. 2020年9月8号,内蒙古《2020年内蒙古自治区重特大疾病慈善医疗救助实施方案》
(1)救助病种目录里,29个单病种中涉及到血友病、多发性硬化、特发性肺动脉高压(包含在目录二十的肺动脉高压中)3种罕见病。
(2)并在目录三十中,纳入了其他突发性、罕见性重特大疾病(参见2018年5月国家卫生健康委员会等5部门联合发布的《第一批罕见病》目录,共涉及121种罕见疾病)。
(3)救助比例随个人支付金额的增加逐步提高,分段报销,最高占扣除各项保险及救助、补助后个人自负部分的50%,每人每年的救助额度最高6万元。
3. 9月29日,河北省医疗保障局发布关于将戈谢病、庞贝氏病特效治疗药物纳入大病保险保障范围的通知 | 政策
通知表示,现将戈谢病、庞贝氏病特效治疗药物注射用伊米苷酶、注射用阿糖苷酶 a 纳入河北省大病保险支付范围,并按各地现有大病保险政策给予报销。
4. 2020年9月,北京市医疗保障局关于将重性精神病门诊治疗等纳入本市基本医疗保险门诊特殊疾病范围的通知
重性精神病、肺动脉高压靶向治疗、C型尼曼匹克病、特发性肺纤维化抗纤维化治疗、耐多药结核、中重度过敏性哮喘生物制剂治疗纳入本市基本医疗保险门诊特殊疾病范围。
此外,门诊使用抗类风湿的单抗英夫利昔单抗等9种药品也获得了医保覆盖。
二、药品审评审批及国外孤儿药资格认定
1. 2020年9月18日,医保局《2020年国家医保药品目录调整通过形式审查的申报药品名单》
在此次公布名单中,罕见病共有18种药物通过形式审查,涉及到13种罕见病。
2. 财政部发布第二批适用增值税政策的抗癌药品和罕见病药品清单的公告 涉及14种罕见病药品制剂
3. 2020年10月9日,辉瑞罕见病创新药维万心®在中国获批
中国国家药品监督管理局已经批准维万心®(氯苯唑酸软胶囊,Vyndamax®,61mg)用于治疗成人野生型或遗传型转甲状腺素蛋白淀粉样变性心肌病(ATTR-CM),以减少心血管死亡及心血管相关住院。维万心®是全球首个、也是唯一经批准治疗ATTR-CM患者的口服药物。
4. 2020年9月2日,海芮思(艾度硫酸酯酶β注射液)获得中国上市批准 | 资讯
北海康成(CANbridge Pharmaceuticals)旗下治疗黏多糖贮积症Ⅱ型(MPSⅡ)的海芮思(艾度硫酸酯酶β注射液)获得中国国家药品监督管理局(NMPA)上市批准,成为国内首个黏多糖贮积症II型酶替代疗法。
5. CDE发布第三批临床急需境外新药名单,三款罕见病治疗药物纳入 | 政策
10月29日,中国国家药品监督管理局药品审评中心(CDE)发布了《关于第三批临床急需境外新药的公示》本次共纳入了7款药,其中针对的适应症包括获得性血栓性血小板减少性紫癜(aTTP)、晚发婴儿型神经元蜡样脂褐质沉积症(CLN2)、多发性硬化三种罕见病。
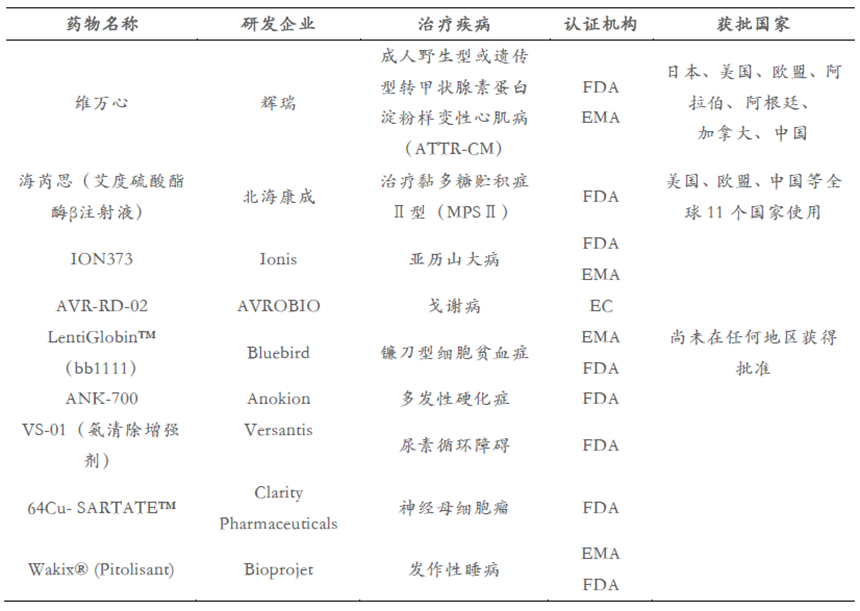
6. 孤儿药资格认证
三、科技部批准建设罕见病国家重点实验室
10月21日,科技部批准建设罕见病国家重点实验室 | 政策
中华人民共和国科学技术部发布《科技部关于批准建设疑难重症及罕见病国家重点实验室的通知》,其中表示为加强疑难重症及罕见病科学研究,服务人民生命健康,经专家评审,科技部决定批准建设“疑难重症及罕见病国家重点实验室”。

四、国家卫生健康委公布第二届罕见病诊疗与保障专家委员会名单
9月2日,国家卫生健康委员会发布第二届罕见病诊疗与保障专家委员会名单。专委会共40人,由钟南山院士、赵玉沛院士、杨胜利院士、张学院士、乔杰院士及李定国、丁洁教授担任顾问,张抒扬教授担任主任委员,李林康同志担任专委会副主任兼办公室主任。
罕见病文献信息
中文标题:相比其他患者,为什么罕见病患者更容易被误诊?基于中国人群的横断面研究
英文标题:Why is misdiagnosis more likely among some people with rare diseases than others? Insights from a population-based cross-sectional study in China.
来源:Orphanet J Rare Dis
发布时间:2020-10-28
作者单位:Dong D, Chung RY, Chan RHW, Gong S, Xu RH. Orphanet J Rare Dis. 2020;15(1):307.
关键词:误诊;信息可及性;罕见病的社会决定因素;横断面研究; 中国
摘要:
背景:对于罕见病患者来说,误诊是阻碍其获得及时治疗的关键问题之一。然而人们对罕见病患者误诊的主要影响因素却知之甚少。
目的:分析2040位中国罕见病患者的调查数据,以探究误诊与患者的人口学、社会经济地位、疾病史和罕见病信息可及性等各种因素之间的关系。
结果:在总样本、成人和儿童之间进行了三项二元logistic回归分析,来评估罕见病(轻度、中度和重度)的误诊率和疾病罕见程度、患者人口统计学特征、医疗保险水平和疾病相关信息可及性之间的关系。结果显示,罕见病信息的可及性是造成患者误诊的最关键因素(OR= 4.459,p< 0.001)。罕见病信息的可及性越差,发生误诊的可能性就越高。在成人(OR=3.732,p<0.001)和非成人(OR=5.174,p<0.001)亚组样本中,均发现罕见病信息可及性对误诊具有影响。患者经济状况对误诊的影响仅在总样本中具有显著性。其他仅有多重疾病这一因素与误诊有显著的相关性,不具有多重疾病的患者发生误诊的可能性较小(OR=0.42,p<0.001)。
结论:研究结果表明,相比其他患者,获取疾病信息困难的罕见病患者发生误诊的概率要高出2~ 5倍。即使在控制了患者的年龄、性别、经济水平和教育水平后,信息可及性对于诊断的影响仍然显著。研究结论揭示了增强罕见病信息可及性对减少患者误诊的重要性。
原文链接:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7594300/
中文标题:赋能中国罕见病患者组织的迫切需求:一项定性研究
英文标题:The urgent need to empower rare disease organizations in China: an interview-based study
来源:Orphanet J Rare Dis
发布时间:2020-10-12
作者单位:Li X, Lu Z, Zhang J, et al. Orphanet J Rare Dis. 2020;15:282. (标签)关键词:罕见病;患者组织;调查问卷;中国
摘要:
背景:一种罕见病仅影响少数人群。但罕见病共有7000多种,这可能影响到10%的人口。罕见病的严重性和对罕见病认知的缺乏,对卫生系统来说是一个巨大的挑战。 在西方国家,患者组织在提高认知、倡导立法和支持药物研发方面发挥着重要作用。
目的: 评估和确定中国罕见病患者组织未满足的需求,为政府和立法机关提供重要信息。
结果: 访谈了中国28个患者组织的代表。大多数组织没有登记注册,没有正式的员工和书面的标准规范以及可靠的财务资源。误诊或延误诊断很常见,而且通常缺乏治疗方案。与西方国家的患者组织不同,由于缺乏资金,中国的患者组织不能资助学术研究。谈到面临的挑战方面,有71.4%的受访者表示公众缺乏对罕见病的认识,而67.9%的受访者表示缺乏财政支持。此外,这些组织中只有7.3%得到了政府的支持,28.6%得到了公众的支持。对于政府的建议方面,由于罕见病通常被排除在基本医疗保险之外,82.1%的受访者选择了罕见病医疗保险专项计划。此外,有78.6%的受访者建议鼓励罕见病领域的研究,75.0%的受访者建议进口孤儿药和71.4%的受访者建议制定有关孤儿药的法规,强调了接受治疗的迫切需要。
结论:由于缺乏支持和对罕见病的认识不足,中国患者组织的发展仍处于早期阶段。为了赋能患者组织,受访者建议政府和立法机关应当颁布孤儿药法案并对罕见病进行官方定义。
原文链接:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7552513/
中文标题:基于美国临床试验数据库的罕见病临床试验现状研究及启示
英文标题:Research Status and Enlightenment of Clinical Trials of Rare Diseases Based on ClinicalTrials.gov
来源:中国医院用药评价与分析
发布时间:2020-09-30
作者单位:周萍,康怡,张东肃,刘丽宏.中国医院用药评价与分析,2020,20(09):1134-1137.
关键词: 罕见病; 临床试验; 特点及启示; ClinicalTrails.gov
摘要:
目的: 探讨国际罕见病临床试验的现状及特点,为促进我国罕见病临床试验管理提供参考和建议。
方法: 以美国临床试验数据库(ClinicalTrails.gov)为基础,全面检索在该平台注册的罕见病临床试验,从注册数量、地域分布、研究类型和进展、设计特点、受试者、研究目的和领域等多个角度,对罕见病临床试验现状和特点展开分析。
结果: ClinicalTrails.gov中累计注册481项罕见病临床试验; 绝大多数试验由发达国家和地区开展; 研究类型主要为干预型; 无分期、Ⅱ期和Ⅲ期临床试验相对较多; 受试者规模多<500例; 研究目的以治疗为主,涉及523种罕见病,主要集中在代谢疾病、神经系统疾病等领域。
结论: 需依据罕见病临床试验特点,探索更多适宜的临床研究新方法和思路; 在现阶段,有必要加强罕见病自然史研究; 从长远看,需从完善制度、加强人才培养、提高创新能力和积极性等方面加强我国罕见病临床研究。
原文链接:
http://d.wanfangdata.com.cn/periodical/zgyyyypjyfx202009030


